Microinjection : Transformation d’un moustique sauvage en un moustique génétiquement modifié

À Target Malaria, notre travail consiste à modifier génétiquement des moustiques. Cela nous permet d’acquérir des connaissances précieuses sur la biologie des moustiques et les mécanismes de transmission du paludisme, ainsi que de créer des outils potentiels spécifiques aux espèces qui pourraient être utilisés pour contribuer à l’élimination du paludisme.
Le matériel génétique ou les « constructions », conçus et créés en laboratoire pour produire ces modifications, doivent être physiquement introduits dans le moustique, où nous pouvons ensuite en analyser les effets.
On nous demande souvent comment nous modifions les moustiques. Dans ce blog, je décris ce processus – la micro-injection.

Photo du moustique Anopheles gambiae, principal vecteur du paludisme
Une fois le mélange d’injection préparé, une solution liquide contenant des copies du matériel génétique, il doit être conservé au frais sur de la glace. Les œufs de moustiques sont ensuite nécessaires pour l’étape suivante.
Pour produire des œufs, les femelles ont besoin de nutriments provenant d’un repas sanguin, qui leur est fourni par un système de gavage artificiel quelques jours auparavant. Comme les moustiques pondent leurs œufs sur l’eau pendant la nuit, ces conditions sont imitées en plaçant leur cage dans l’obscurité avec un plat de papier mouillé. Au bout de 15 minutes, il y a généralement suffisamment d’œufs pondus pour commencer.
Bien que ces œufs soient généralement appelés « œufs », il s’agit plus précisément d' »embryons », car les femelles se sont déjà accouplées avec un mâle et les œufs ont été fécondés, chaque embryon commençant déjà à se développer en une petite larve à l’intérieur de sa coquille.
Une fois la ponte effectuée, la fenêtre d’injection est limitée à moins d’une heure ! Si vous êtes trop tôt, les embryons sont trop mous et délicats, et si vous êtes trop tard, ils deviennent fermes et pressurisés à l’intérieur. La couleur des embryons est un bon indicateur : fraîchement pondus, ils sont blanc-jaune pâle et s’assombrissent avec le temps à mesure qu’ils développent des pigments ; la couleur intermédiaire gris clair est donc idéale.
Pour que les embryons restent hydratés et en place pendant l’injection, un stéréomicroscope (un microscope à deux yeux qui permet d’obtenir une image en 3D par rapport à un microscope conventionnel à un œil) et un pinceau sont utilisés pour les aligner soigneusement sur une lame de microscope en verre contre un papier nitrocellulose fin, avec un papier filtre humide plus épais par-dessus. Le positionnement de l’embryon et la section spécifique à injecter sont des facteurs cruciaux pour assurer un accès facile à l’aiguille.
Les embryons de moustiques et d’autres insectes commencent avec de nombreuses copies de leur matériel génétique sous forme de « noyaux » à l’intérieur d’une seule cellule, qui sont ensuite compartimentés en cellules individuelles. En théorie, n’importe quel noyau/cellule peut être modifié, mais ce ne sont que ceux qui forment les cellules reproductrices de la « lignée germinale » – c’est-à-dire, si l’embryon est une femelle, leurs futurs œufs, ou si c’est un mâle, leurs futurs spermatozoïdes – qui subiront les modifications dans leur progéniture, transmises à la génération suivante, et à la suivante… Ces noyaux sont situés à l’extrémité postérieure (arrière) de l’embryon, qui peut être identifiée par son aspect légèrement plus mince et plus pointu que l’extrémité antérieure (avant), où se forme la tête. L’embryon est donc placé avec l’extrémité postérieure en haut.

Les embryons sont transférés en position contre un papier fin à l’aide d’un pinceau.
Une fois alignés (~30-50 par lame), les embryons sont placés sous un microscope inversé (où la lumière vient du haut et les lentilles du bas, à l’inverse d’un microscope conventionnel) qui permet une visualisation facile.
Les œufs étant si petits (environ un demi-millimètre), il serait impossible de les injecter à la main. C’est pourquoi un équipement spécialisé est utilisé pour contrôler les mouvements précis d’une aiguille et l’écoulement du mélange à injecter.
Une aiguille très fine en verre de quartz, également fabriquée dans le laboratoire, est chargée du mélange d’injection et fixée dans un support, avec une pression d’air fournie par des tubes et une pompe à l’arrière pour contrôler le flux de liquide. Les mouvements de l’aiguille sont commandés par un joystick et la pression d’injection est contrôlée par un boîtier de commande informatique et une souris. En cliquant sur un bouton, le mélange est injecté, ce qui se traduit par un léger mouvement du contenu à l’intérieur de l’embryon.


Chargement de l’aiguille de micro-injection avec le mélange
Micro-injection des embryons
Une grande attention est nécessaire pour que les embryons reçoivent suffisamment de solution pour introduire le matériel génétique au bon endroit sans causer de dommages. Il s’agit d’une compétence spécifique dont l’apprentissage peut prendre un certain temps.

Injection d’embryons
Après l’injection, les embryons sont placés dans un pot d’eau entouré de papier mouillé. Au cours des deux jours suivants, ils se transforment en larves et commencent à éclore en se tortillant dans l’eau.
Comme les modifications ne sont pas visibles, nous incluons également un gène qui produit une protéine fluorescente qui brille sous un microscope avec une lumière laser à une longueur d’onde spécifique. Cette fluorescence agit comme un « marqueur » et permet de suivre les modifications génétiques.
Lorsque les embryons injectés éclosent sous forme de larves, ils peuvent présenter une expression « transitoire » de ce marqueur au site d’injection, ce qui indique que l’injection a réussi.
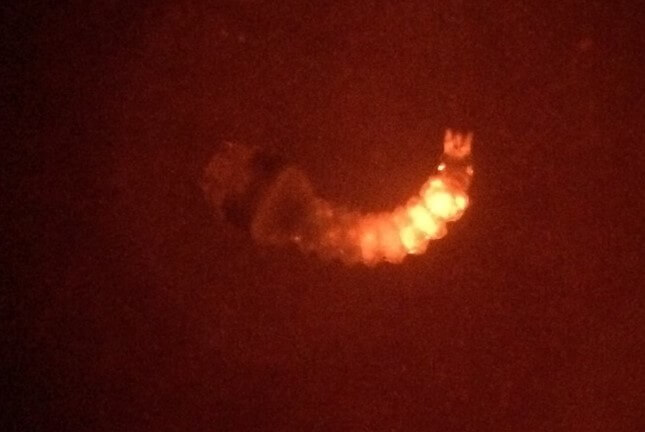
Le moustique injecté a éclos sous la forme d’une larve présentant une expression transitoire.
Comme indiqué, le matériel génétique doit non seulement être présent, mais aussi intégré dans les cellules germinales pour être transmis à la génération suivante. Ainsi, une fois adultes, les moustiques injectés sont tous croisés avec des moustiques du sexe opposé (normalement des types sauvages pour maximiser le nombre) et leur progéniture est examinée pour détecter ceux qui sont « transgéniques », c’est-à-dire qui ont entièrement hérité des modifications.
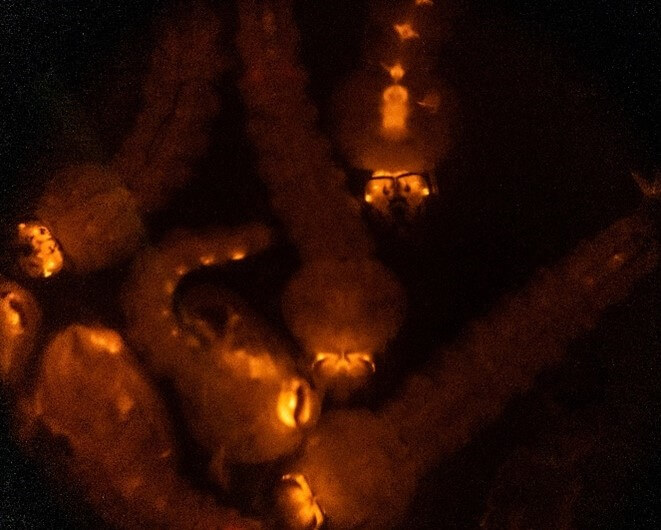
Progéniture de moustiques injectés présentant une expression transgénique
Les transgéniques sont contrôlés moléculairement en laboratoire pour s’assurer que le matériel génétique s’est intégré comme prévu. L’étude des effets des modifications peut alors commencer…
