Le déchiquetage du chromosome Y chez Anopheles gambiae : une nouvelle souche de sexage génétique permet de mieux comprendre la biologie des distordeurs synthétiques du sexe-ratio

Il existe des éléments génétiques naturels, connus sous le nom de « la pulsion méiotique du sexe-ratio » (sex ratio meiotic drive) qui peuvent influencer le rapport du nombre de mâles et de femelles dans la progéniture, en favorisant soit le sexe mâle, soit le sexe femelle. Ces éléments ont été observés dans de nombreux groupes de plantes et d’animaux, notamment chez les insectes et les mammifères.
En plus d’être un phénomène biologique fascinant, la capacité de ces mécanismes génétiques à contrôler le sexe-ratio pourrait être un outil puissant pour développer de nouvelles stratégies de lutte contre les vecteurs, afin de réduire la propagation des maladies. Dans le cas du principal vecteur du paludisme, Anopheles gambiae, ce phénomène pourrait être utilisé dans les stratégies de lutte antivectorielle pour réduire le nombre de femelles infectées porteuses du parasite du paludisme.
S’il est conçu en laboratoire, ce système peut être utilisé pour réduire le nombre de femelles dans la descendance, ce qui permet de réduire la population d’une espèce cible.
Il y a quelques années, le laboratoire Crisanti a mis au point un système synthétique de distorsion du sexe-ratio chez Anopheles gambiae. L’étude a montré que la réduction du nombre de femelles par la modification du sexe-ratio de la progéniture en faveur des mâles peut entraîner l’effondrement d’une population de moustiques en laboratoire sur quelques générations. La souche, appelée « mâle biaisé » ou « Ag(PMB)1 », est un outil puissant pour la lutte antivectorielle, et des études préliminaires testent actuellement son efficacité sur le terrain.
Avant d’expliquer nos travaux récents, il est important de détailler certaines caractéristiques de la biologie génétique et de la reproduction des moustiques anophèles.
Le moustique An. gambiae possède une paire de chromosomes sexuels (XX et XY, comme chez l’homme) et une paire d’autosomes. Lorsqu’un moustique hérite d’une paire de chromosomes XY de ses parents, il se développe comme un mâle. Lorsqu’un moustique hérite d’une paire de chromosomes XX, il se développe comme une femelle. Comme chez l’homme, les moustiques mâles sont responsables de la détermination du sexe de la progéniture. Après l’accouplement du moustique, les spermatozoïdes porteurs de chromosomes X ou Y fécondent l’ovule de la femelle, donnant naissance à des individus femelles (XX) ou mâles (XY). En général, la probabilité qu’un spermatozoïde porteur d’un Y féconde l’ovule est la même que celle d’un spermatozoïde porteur d’un X, ce qui fait que l’embryon a 50 % de chances d’hériter d’un chromosome X ou Y. Cela se traduit par la présence d’un nombre égal de mâles et de femelles dans la descendance du moustique.
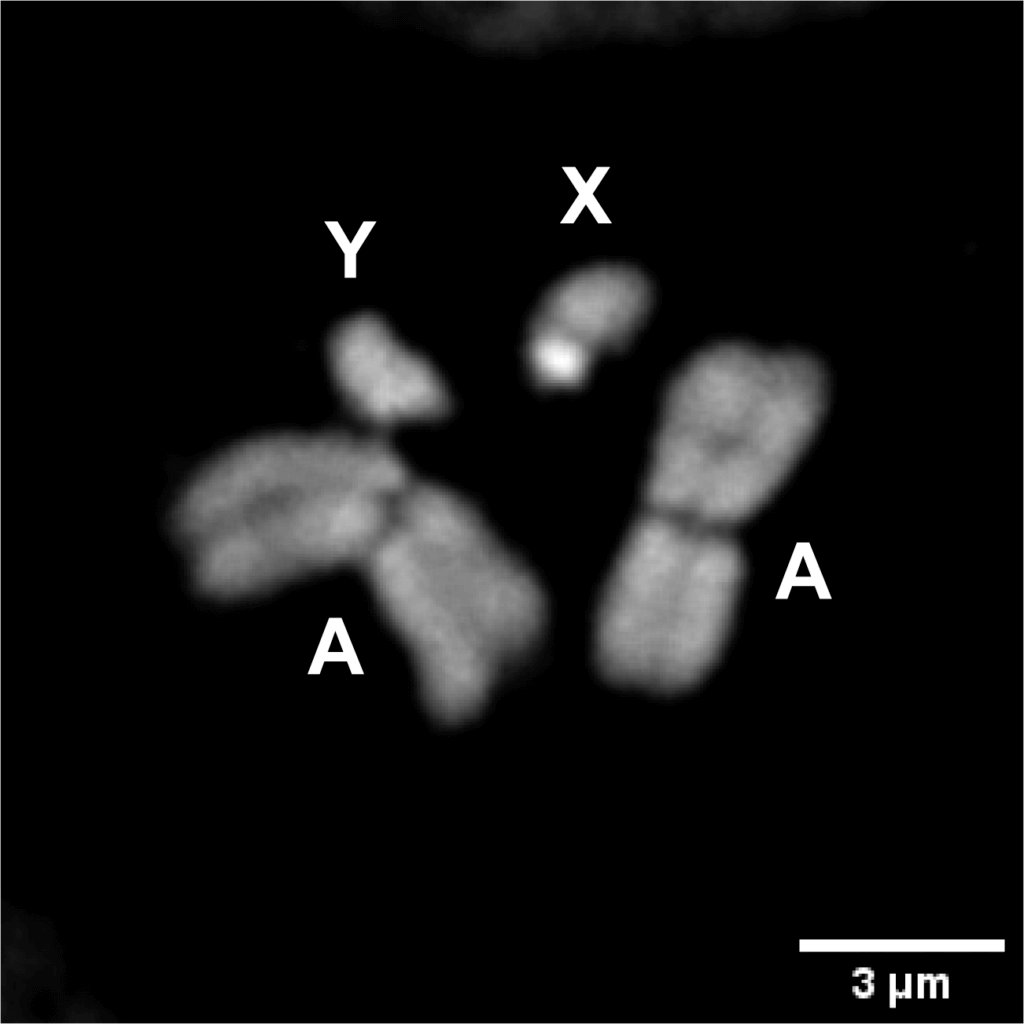
Fig1 : Coloration du caryotype des chromosomes mitotiques du moustique mâle An. gambiae Autosomes (A), chromosome X (X), chromosome Y (Y).
Le système synthétique de distorsion du sexe-ratio (souche Ag(PMB)1) agit en modifiant ce processus, pendant la formation des spermatozoïdes porteurs de X ou de Y dans l’organe reproducteur du moustique. Plus précisément, une endonucléase telle que Ippol ou Cas9 peut être utilisée pour cibler un chromosome sexuel spécifique au cours de la gamétogenèse masculine. Le chromosome X peut être « déchiqueté », ce qui entraîne la production de spermatozoïdes porteurs de X non fonctionnels, tandis que les spermatozoïdes porteurs de Y restent intacts et capables de féconder les ovules. Cela augmente la probabilité que les spermatozoïdes porteurs de l’Y fécondent les ovules, ce qui donne une progéniture à prédominance masculine.
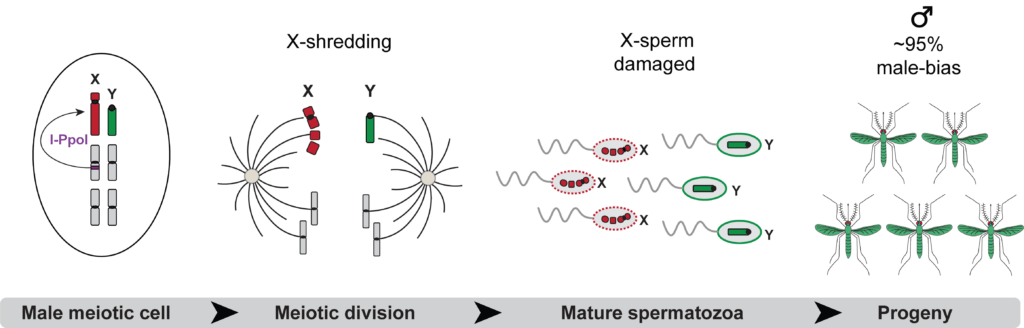
Fig2 : Mécanisme moléculaire du système de déchiquetage du chromosome X. Le ciblage des séquences répétitives sur le chromosome X du moustique entraîne la formation de spermatozoïdes endommagés porteurs du X. Par conséquent, seuls les spermatozoïdes porteurs du Y peuvent féconder les ovules, ce qui entraîne une prédominance masculine dans la descendance.
Maintenant que nous avons présenté les mécanismes de base du fonctionnement des perturbateurs synthétiques du sexe-ratio, nous pouvons présenter notre dernière étude publiée dans Plos Genetics.
Notre recherche visait à déterminer s’il était possible d’induire un biais féminin dans la progéniture en « déchiquetant » le chromosome Y pendant la gamétogenèse mâle chez Anopheles gambiae.
Contrairement au chromosome X, la composition des séquences du chromosome Y de l’anophèle est mal caractérisée, ce qui rend difficile l’identification de sites cibles uniques liés au chromosome Y pour le déchiquetage chromosomique. Pour cette raison, nous avons dû utiliser deux approches différentes, combinant les analyses in silico et la cytogénétique, pour identifier un site cible unique sur le chromosome Y.
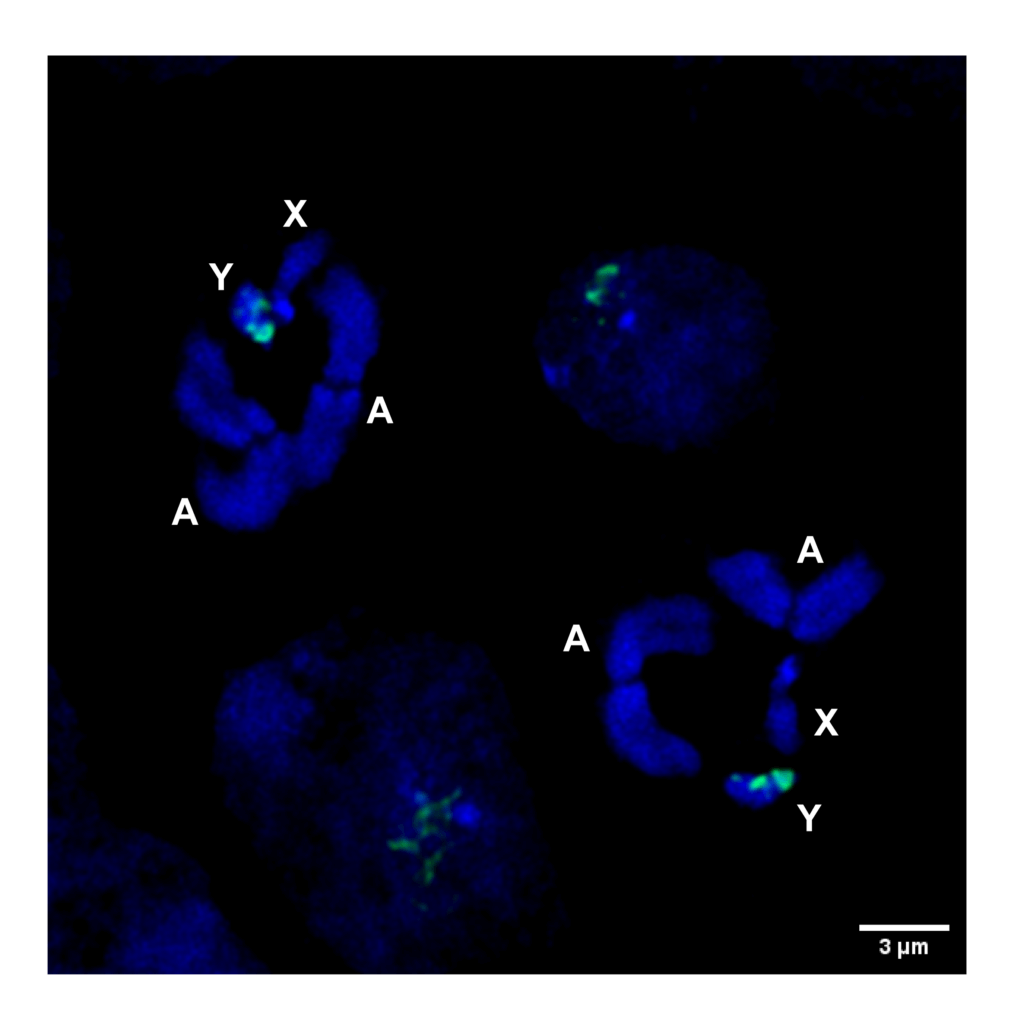
Fig3 : Hybridation in situ en fluorescence (FISH) de l’ADN sur un chromosome mitotique d’An. gambiae obtenu à partir du testicule mâle montrant l’emplacement du site cible utilisé pour le déchiquetage du chromosome Y. A (Autosome), X (chromosome X), Y (chromosome Y). Vert = satellite lié à l’Y, bleu = DAPI.
Après avoir sélectionné le site cible, nous avons utilisé le système CRISPR/Cas9 pour cibler les séquences répétitives dans le chromosome Y pendant la gamétogenèse mâle. Après quelques tentatives, nous avons constaté que les moustiques hébergeant notre construction génétique généraient une progéniture à forte dominante féminine (99 %) sans réduction de leur aptitude, ce qui suggère que notre système ciblait la bonne quantité de séquences liées au chromosome Y pour induire le déchiquetage du chromosome Y dans le testicule mâle.
Étant donné que les mécanismes cellulaires impliqués dans la distorsion du sexe-ratio induite par le distordeur synthétique de sexe-ratio sont largement inconnus, nous avons également étudié l’impact du déchiquetage du chromosome Y sur le processus méiotique de sélection des spermatozoïdes en utilisant l’hybridation fluorescente in situ (FISH) de l’ADN. La FISH est une technique qui permet de marquer avec des sondes fluorescentes une région spécifique des chromosomes. De manière surprenante, nous avons découvert que le niveau élevé de distorsion du sexe-ratio observé était lié à la présence d’un processus de sélection des spermatozoïdes agissant contre les spermatozoïdes défectueux avant que la fécondation n’ait lieu dans la spermathèque de la femelle.
Les résultats de cette étude nous permettent de mieux comprendre les mécanismes moléculaires et biologiques à l’origine des distorsions synthétiques du sexe-ratio chez les moustiques anophèles, ce qui pourrait contribuer à l’élaboration de stratégies de lutte antivectorielle ciblant également le sexe-ratio chez d’autres organismes. Enfin, nous présentons une souche génétique de sexage capable de produire essentiellement des femelles, ce qui constitue un outil génétique précieux pour les études fondamentales sur ce vecteur mortel.
Cette souche pourrait être utilisée, en combinaison avec la souche dont le chromosome X est déchiqueté, le « mâle biaisé », comme système de sexage prézygotique, permettant la production de lots d’embryons mâles et femelles.
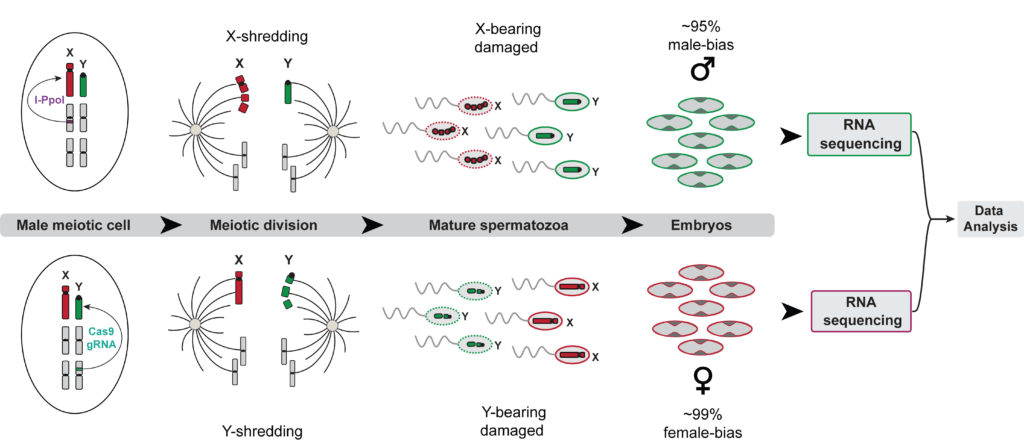
Fig4: Le système de sexage prézygotique permet de collecter un grand nombre d’embryons mâles et femelles pour réaliser des expériences de séquençage de l’ARN afin d’étudier les différences entre l’expression des gènes des embryons mâles et femelles à un stade précoce du développement.
Ce système de sexage innovant permet diverses expériences de séquençage, ouvrant la voie à une compréhension plus approfondie du développement mâle et femelle aux premiers stades chez Anopheles gambiae, ce qui pourrait contribuer à l’amélioration des stratégies de lutte contre le paludisme.
